神戸大学大学院医学研究科シグナル統合学分野の的崎尚教授と村田陽二准教授、栁田匡彦大学院生らの研究グループは、がん細胞を食べる (貪食) 能力を持つマクロファージ注1) 上のSIRPαという特殊なタンパク質に対する抗体注2) を用いることで、マクロファージが活性化され、がん細胞を効率よく排除することが出来ることを明らかにしました。この発見は、今後、新たながん治療薬の開発に繋がることが期待されます。この研究成果は、平成29年1月12日に、米国医学誌「JCI Insight」にオンライン掲載されました。
研究の背景
依然としてがんは我が国の死因の第一位であり、より有効な治療薬の開発が望まれています。近年、がん細胞や正常細胞に存在する特定のタンパク質に作用する薬剤 (分子標的薬) によるがん治療が行われ、その効果が注目されています。しかし、これら分子標的薬に対する耐性がん細胞の出現や従来の抗がん剤とは異なる副作用などが問題となりつつあり、分子標的薬の更なる改良や開発が求められています。
研究の成果
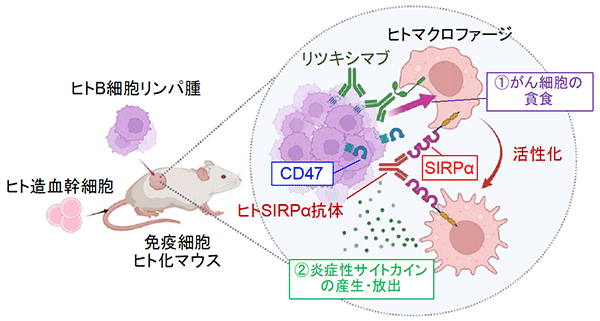
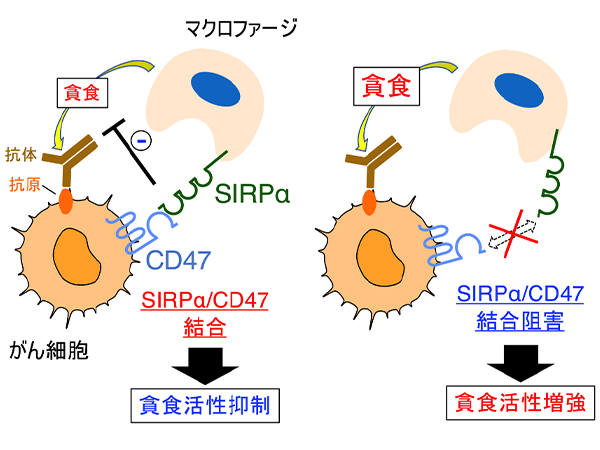
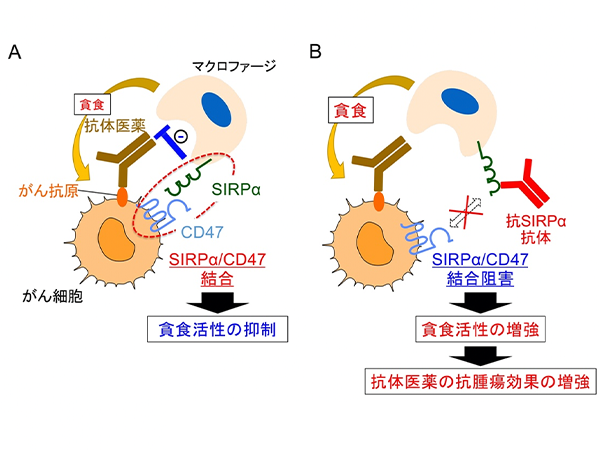
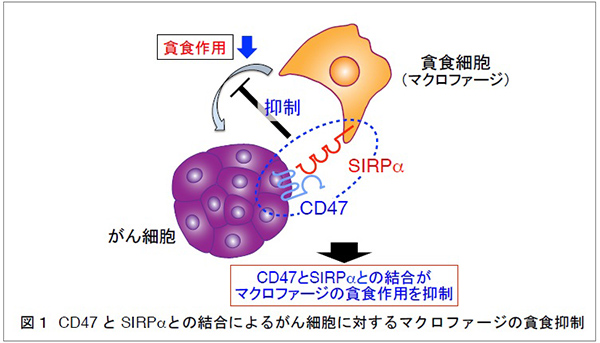
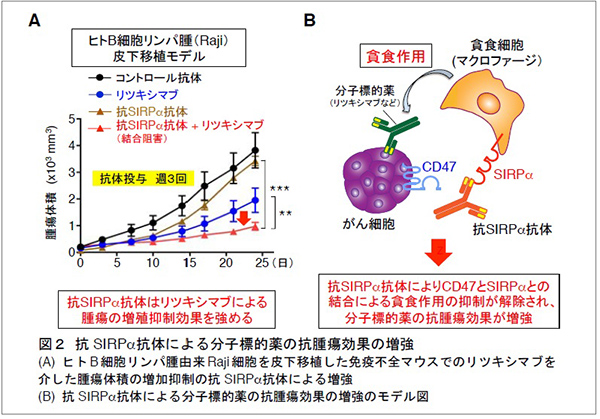
これまでに、的崎教授らの研究グループは、マクロファージの細胞膜に存在するタンパク質SIRPαとその貪食標的となる細胞 (がん細胞や老化細胞など) の細胞膜に存在するタンパク質CD47が結合すると、マクロファージの貪食作用が抑制されることを見つけていました (図1)。今回、研究グループは、ヒトB細胞リンパ腫由来Raji細胞を皮下移植した免疫不全マウス注2) を用いることで、SIRPαに特異的に結合し、CD47とSIRPαの結合を阻害する抗体 (抗SIRPα抗体) が、分子標的薬リツキシマブ注4) による腫瘍体積の増加抑制 (腫瘍の増殖抑制) を増強することを見いだしました (図2A)。さらに、CD47とSIRPαの結合を阻害する抗SIRPα抗体により、リツキシマブによるマクロファージのRaji細胞に対する貪食作用が強められることを示しました。これらのことから、CD47とSIRPαの結合を阻害する抗SIRPα抗体が、リツキシマブなどの分子標的薬によるがん細胞に対するマクロファージの貪食作用を高めることで、強力な抗腫瘍効果を発揮すると考えられました (図2B)。
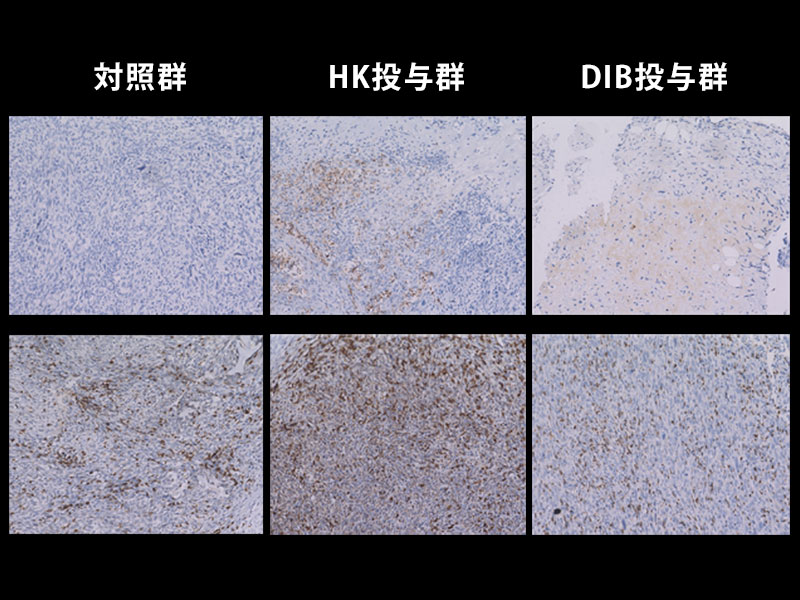
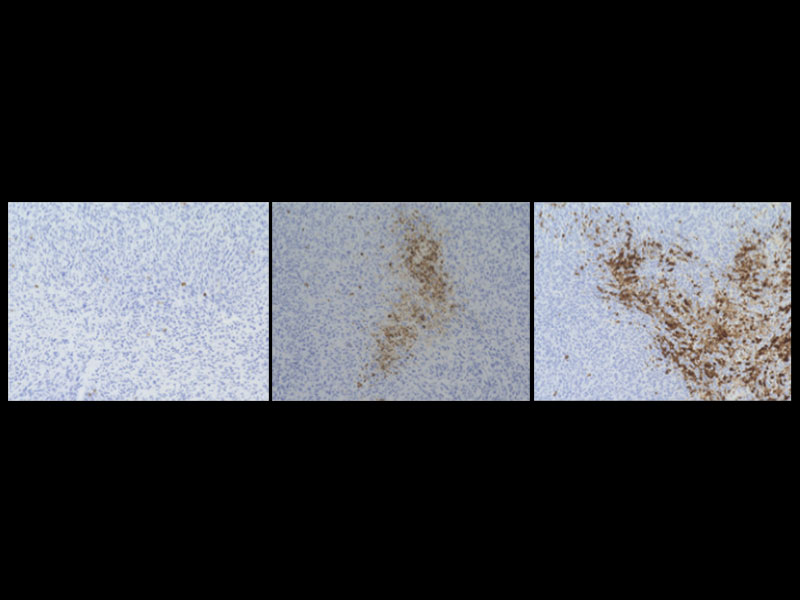
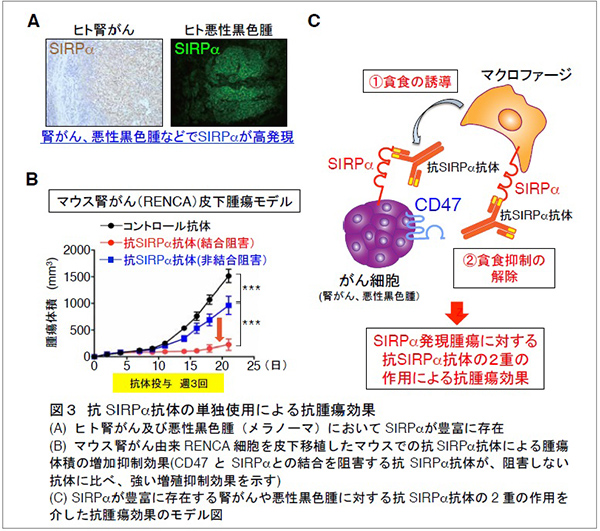
また、研究グループは、ヒト及びマウスの腎がん、悪性黒色腫 (メラノーマ) にSIRPαが豊富に存在することを見いだし (図3A)、マウス腎がん又は悪性黒色腫由来の株化細胞を移植した野生型マウスにおいて、抗SIRPα抗体の単独投与が、腫瘍の増殖や転移を抑えることを見つけました (図3B)。一方、薬剤によりマクロファージを消失させたマウスでは、上記の抗SIRPα抗体によるマウス由来腎がん細胞に対する抗腫瘍効果が弱まることを示しました。さらに、マクロファージと腎がん又は悪性黒色腫由来がん細胞を用いた貪食実験から、抗SIRPα抗体が、 (1) がん細胞のSIRPαに直接結合することでマクロファージによるがん細胞の貪食作用を誘導する、 (2) がん細胞とマクロファージ間のCD47とSIRPαの結合を阻害しマクロファージの貪食抑制を解除 (マクロファージの活性化) することが分かり、抗SIRPα抗体による抗腫瘍効果は上記の二重の作用を介したものであると考えられました (図3C)。
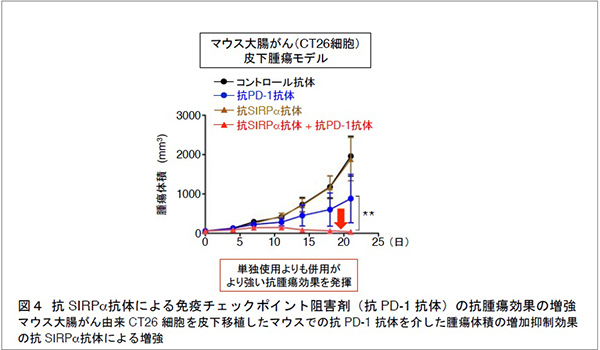
近年、抗腫瘍免疫を担う細胞傷害性T細胞注5) を抑制する免疫チェックポイント分子注6) の一つであるPD-1タンパク質の機能を阻害する抗PD-1抗体注7) が、抗がん剤として有効性を示すことが明らかとなり注目されています。興味深いことに、マウス大腸がん由来の株化細胞を皮下移植した野生型マウスにおいて、抗SIRPα抗体と抗PD−1抗体の同時投与が、それぞれの単独投与に比べ、腫瘍体積の増加を強く抑制しました (図4)。この抗SIRPα抗体の詳細な作用機序については十分には分かっていませんが、抗PD-1抗体などの細胞傷害性T細胞に対する免疫チェックポイント阻害剤と抗SIRPα抗体との併用が、それぞれの単独使用よりも強い抗腫瘍効果をもたらすと考えられました。
今後の展開
本研究は、マクロファージという自然免疫に関わる細胞の免疫チェックポイント分子であるSIRPαに対する抗体が、新たながん治療薬として利用できることを明らかにしたと言えます。今後、抗SIRPα抗体の持つ抗腫瘍効果のより詳細な作用機序を解析すると共に、安全性を厳密に評価することで、がん治療薬としての抗SIRPα抗体の開発へと繋がることが期待されます。
参考図
用語解説
注1) マクロファージ
生体内に侵入した病原体などを貪食し排除する (自然免疫と呼ばれる) のに特化した免疫細胞。また、老化した細胞やがん細胞などを貪食し、生体内からの不要な細胞の排除に関わる。
注2) 抗体
免疫細胞の中でもリンパ球であるB細胞により産生され、抗原と呼ばれる特定の分子 (タンパク質など) と特異的に結合する性質を持つタンパク質。
注3) 免疫不全マウス
自己と異なる細胞を移植した際にその拒絶反応を担うT細胞やB細胞などの免疫細胞を失った、正常な免疫機能を持たないマウス。例えば、T細胞とB細胞を失った免疫不全マウスには、異なる動物種であるヒト由来のがん細胞などを移植することが出来る。
注4) リツキシマブ
細胞の膜上に存在するCD20と呼ばれているタンパク質と特異的に結合する抗体 (抗CD20抗体) であり、主に悪性リンパ腫の抗がん剤として用いられている。CD20は正常なB細胞や悪性リンパ腫の中でもB細胞リンパ腫に豊富に存在することが知られている。
注5) 細胞傷害性T細胞
正常な細胞と異なるがん細胞やウイルス感染を受けた細胞などを異物として認識し、破壊する作用を持つ免疫細胞であるリンパ球の一つ。
注6) 免疫チェックポイント分子
免疫反応のブレーキとして機能する分子。例えば、免疫チェックポイント分子として細胞傷害性T細胞などの細胞膜に存在するPD-1と呼ばれるタンパク質などが挙げられる。PD-1はがん細胞やウイルス感染細胞を破壊する細胞傷害性T細胞の免疫反応を弱める作用を持つことが知られている。
注7) 抗PD-1抗体
PD-1に特異的に結合する抗体であり、特に、PD-1の持つ機能を阻害する抗体のことを免疫チェックポイント阻害剤とも呼ぶ。
論文情報
タイトル
“Anti-SIRPα antibodies as a potential new tool for cancer immunotherapy”
(新たながん治療薬としての抗SIRPα抗体)DOI
10.1172/jci.insight.89140
著者
栁田匡彦1,2、村田陽二1、田中大介1、茂木精一郎3、新井恵吏4,5、Edwin Widyanto Daniwijaya1、羽間大祐1、鷲尾 健1、齊藤泰之1、小谷武徳1、大西浩史6、Per-Arne Oldenborg7、 Noel Verjan Garcia8、宮坂昌之8,9、石川 治3、金井弥栄4,5、古森孝英2、的崎 尚1
- 神戸大学大学院医学研究科 生化学・分子生物学講座 シグナル統合学分野
- 神戸大学大学院医学研究科 外科系講座 口腔外科学分野
- 群馬大学大学院医学系研究科 皮膚科学
- 国立がん研究センター研究所 分子病理分野
- 慶應義塾大学医学部 病理学教室
- 群馬大学大学院保健学研究科 生体情報検査科学講座
- Department of Integrative Medical Biology, Section for Histology and Cell Biology, Umeå University, Umeå, Sweden
- 大阪大学大学院医学系研究科 感染免疫医学講座 免疫動態学
- MediCity Research Laboratory, University of Turku, Finland
掲載誌
JCI Insight