神戸大学医学研究科細胞生理学分野の西田満准教授と南康博教授らの研究グループは、Victor W. Hsu教授 (ハーバード大学医学部) およびGregory J. Pazour教授 (マサチューセッツ大学医学部) らとの国内・国際共同研究によって、IFT20 (intraflagellar transport 20) と呼ばれる細胞内タンパク質が、ゴルジ体からの微小管形成を促進することで、がん細胞の浸潤 (※周りに広がっていくこと) を促進させることを発見しました。
IFT20はヒトの殆ど全ての細胞に存在する一次繊毛の形成と機能に必須なタンパク質として知られており、一方、多くのがん細胞は一次繊毛を消失していますが、がん細胞におけるIFT20の役割は知られていませんでした。今回、IFT20のがん細胞における機能がはじめて明らかにされました。
今後、IFT20を標的としたがん細胞浸潤の阻害方法の開発など、新たな治療法の開発への応用が期待されます。
この研究成果は、1月26日 (日本時間19時) に英国科学雑誌「Scientific Reports」にオンライン掲載されました。
研究の背景
がんによる死亡原因のほとんどは、浸潤とそれに続いて起こる転移によるといわれており、がん細胞の浸潤を司る分子メカニズムの解明と、それに基づいた革新的がん治療方法の開発が急務となっています。
ヒトの殆ど全ての細胞表面には、「細胞のアンテナ」として細胞外情報を感受する一次繊毛が存在していますが、多くのがん細胞は一次繊毛を消失していることが知られています。IFT20は正常な一次繊毛の形成と機能に必須なIFTタンパク質のひとつですが、一次繊毛を消失したがん細胞においてIFTタンパク質がどのような機能を担っているのかは知られていませんでした。
他方、Ror2と呼ばれる細胞 (表面) 膜タンパク質は、様々ながん細胞で過剰に発現し、がん細胞の浸潤・転移を促進することが示されていますが、その分子メカニズムについては不明な点が多く残されています。
研究の内容
西田准教授らは、一次繊毛を消失した諸種のがん細胞を用いて、Ror2がIFT20の発現を誘導することによって、がん細胞の浸潤を促進することを発見しました。
多くのがん細胞は、浸潤突起と呼ばれる構造を形成することで、がん細胞の浸潤に対する障壁 (バリア) となる基底膜などの細胞外基質を分解し、周囲へ浸潤することが知られています (図参照)。浸潤突起の形成には、ゴルジ体を介した細胞内輸送システムによるタンパク質や膜の供給が必要であり、そのためがん細胞のゴルジ体は浸潤突起に近接して配置していると考えられています。本研究では、IFT20がゴルジ体タンパク質GM130およびAKAP450と複合体を形成することで、ゴルジ体からの微小管形成を促進し、浸潤突起形成に重要なゴルジ体の配置とゴルジ体内のタンパク質輸送を制御していることが証明されました。本研究により、ゴルジ体由来微小管の形成に関わる新たな分子メカニズムと、そのがん細胞浸潤における重要な役割が明らかになりました。
今後の展開
多くのがん細胞は一次繊毛を消失していますが、一次繊毛の消失とがん形質との関係は明らかではありません。IFT20は正常細胞における一次繊毛の形成・機能に関わっていますが、一次繊毛を消失したがん細胞においては、IFT20が浸潤突起の形成を担っていることが明らかになりました。今後、がん細胞におけるIFT20の機能と一次繊毛の消失との関連について解析を進めることで、がん細胞ではなぜ一次繊毛が消失しているのかという、根本的問題の解明に繋がると期待されます。また、IFT20のがん細胞特異的な制御メカニズムを見出すことで、IFT20を標的としたがん細胞浸潤の阻害方法の開発などへの応用が期待されます。
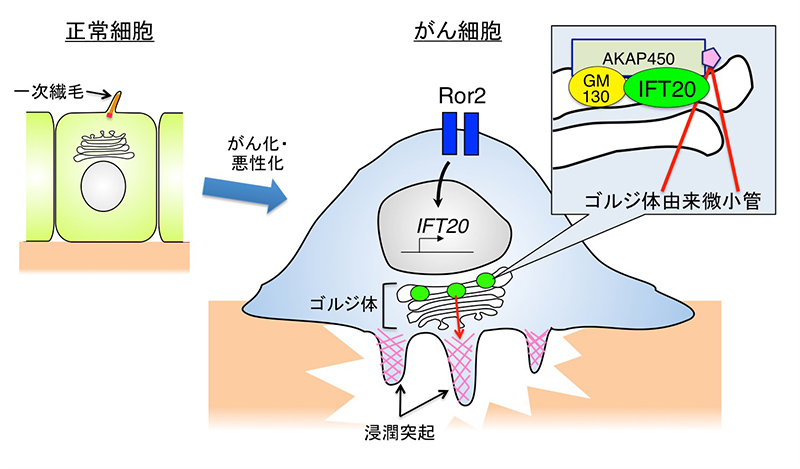
正常細胞においてIFT20は一次繊毛の形成と機能を制御している。がん細胞はRor2の過剰発現に伴ってIFT20の発現を誘導・維持するとともに、一次繊毛を消失すると考えられる。IFT20はゴルジ体においてGM130-AKAP450複合体と結合することでゴルジ体からの微小管形成を促進し、浸潤突起形成に重要なゴルジ体の配置とゴルジ体内タンパク質輸送を制御する。
論文情報
- タイトル
- “Ror2 signaling regulates Golgi structure and transport through IFT20 for tumor invasiveness”
- DOI
- 10.1038/s41598-016-0028-x
- 著者
- Michiru Nishita1, Seung-Yeol Park2, Tadashi Nishio1, Koki Kamizaki1, ZhiChao Wang1, Kota Tamada3, Toru Takumi3, Ryuju Hashimoto4, Hiroki Otani4, Gregory J. Pazour5, Victor W. Hsu2, Yasuhiro Minami1
- Division of Cell Physiology, Department of Physiology and Cell Biology, Kobe University, Graduate School of Medicine
- Division of Rheumatology, Immunology and Allergy, Brigham and Women’s Hospital, and Department of Medicine, Harvard Medical School
- RIKEN Brain Science Institute
- Department of Developmental Biology, Faculty of Medicine, Shimane University
- Program in Molecular Medicine, University of Massachusetts Medical School
- 掲載誌
- Scientific Reports