神戸大学科学技術イノベーション研究科の西田敬二教授・近藤昭彦教授、筑波大学生命環境系の江面浩教授・有泉亨准教授、名城大学の寺田理枝教授らの研究グループは、DNAを切らずに書き換える新たなゲノム編集技術「Target-AID」を植物に最適化することにより、本新規ゲノム編集技術が農作物の育種に応用可能であることを実証しました。
本研究の成果は、3月27日 (日本時間28日午前0時) に Nature biotechnology 誌オンライン版で先行公開されました。
研究の背景
私たちの食卓に並ぶ農作物は、大きさや味といった形質をこれまでの人類の長い歴史を通して変えながら育まれたものです。この過程を品種改良といい、栽培者の好みに応じて集団の中から選抜したり、品種の掛け合わせにより理想的な形質 (遺伝子変異の組み合わせ) をもつ子孫を作出することで、新しい品種が生まれてきました。しかし、これらの方法では新しい品種を獲得するために長い年数が掛かります。また化学物質や紫外線、放射線といった変異原によって、人工的に遺伝子変異を誘導する突然変異育種といった技術も生み出されてきましたが、狙った遺伝子を変えるには偶然に頼るしかなく、不確実性の高いものでした。
そこで近年、注目されている技術が「ゲノム編集技術」です。一般的なゲノム編集技術は標的とするDNA配列を特異的に認識し、その標的部位において人工ヌクレアーゼがDNAを二重鎖切断することによって、変異を導入する技術です。つまり偶然ではなく、狙った遺伝子に特異的に変異を引き起こすことができます。ゲノム編集は、世界の気候変動や病害虫による被害拡大といった食糧や農業の課題解決のための、より精密かつ効率よく新しい品種を作る育種技術としても注目されています。
研究内容と成果
本研究では、西田教授ら(Nishida et al., 2016)が開発した新たなゲノム編集ツールである「Target-AID」を植物用に最適化し、イネやトマトという農作物の品種改良への応用可能性について調査しました。ゲノム編集技術の1種であるCRISPR-Cas9システムは、ガイドRNAによって認識された標的遺伝子をCas9ヌクレアーゼにより切断し、塩基欠損や挿入を引き起こしてゲノムを改変する技術であるため、遺伝子の機能自体を壊す変異が起きることがほとんどです。一方Target-AIDは、CRISPR-Cas9システムのヌクレアーゼに代わり、脱アミノ化反応機構を採用しているため、DNAを切らずにシトシン塩基からチミン塩基に書き換えることができる新たなゲノム編集技術です。遺伝子の変異の入り方によっては、遺伝子の機能を失わずに済むだけではなく、遺伝子の機能を付与することができます。
まずイネでは、除草剤耐性イネの作出を行ないました。アセト乳酸合成酵素 (ALS) 遺伝子変異体は、ALS遺伝子の287番目のシトシン塩基がチミン塩基に置換することにより、96番目のアラニンがバリンに置換して翻訳されると、除草剤イマザモックス耐性をもつことが知られています。287番目のシトシン塩基の上流18塩基前の位置に標的配列を作成したところ、イマザモックス耐性をもつカルスを獲得することに成功しました (図1a, b)。またこれらのカルスは正常に再分化し、植物体を形成しました (図1c)。さらに、ALS遺伝子と同時に、イネの芳香族アミノ酸経路に関わるOsFTIP1e遺伝子の2箇所の合計3箇所を同時に標的とした遺伝子改変イネの作出を行ない、3ヵ所同時に塩基の置換や挿入、欠損といった変異をもつ個体が確認されました (図2)。塩基の挿入や欠損といった変異が起こると、塩基のずれによりコードされたアミノ酸配列も変化し、タンパクの機能に影響を引き起こします。
また、トマトにおいて、双子葉であるシロイヌナズナに最適化したCas9タンパク質に改変したTarget-AIDを用いて、遺伝子改変を行いました。植物ホルモンのエチレンを感受する受容体の遺伝子SlETR1※1と、ジベレリンのシグナル伝達に関与する遺伝子SlDELLA ※2といった品種改良目的にもつながる遺伝子を標的としました。その結果、どちらの遺伝子においても塩基の置換や挿入、欠損が見られました。さらにこれらの遺伝子改変トマトの後代を調査したところ、次世代にもその変異が遺伝し、その変異の結果から予想される葉の縁の切れ込みが少なくなるといった表現型も確認されました (図3b, c)。SlDELLA変異体は受粉をしなくとも果実を形成する性質・単為結果性をもち、受粉作業の労働時間や着果促進剤のコスト削減につながります。
さらに、ゲノム編集を行うためには、Target-AIDを働かせる配列 (ベクター配列) をゲノム中に存在させることが必要ですが、遺伝子改変トマトの後代の中には世代を重ねるうちにベクター配列が失われている個体が見つかりました (図3a)。つまり、狙った遺伝子の変異以外に痕跡がない植物体が獲得されたことになります。また、ゲノム編集技術の育種技術として応用を目指すに当たって、標的配列以外の配列にヌクレアーゼが働き、予期していない変異が誘発されていない (オフターゲット) かの調査を行いましたが、イネとトマト両方において、明らかなオフターゲットは検出されませんでした。
これらのことから、新たなゲノム編集技術「Target-AID」は、単子葉・双子葉に関わらず、幅広い作物で使用可能であり、塩基置換による有用な形質をもつ作物の開発での使用に期待できることを実証しました。
今後の展開
本研究では、実験用品種を用いた成果が得られましたが、今後は飼料用米や大玉トマト品種など、より実用に近い品種において、新たなゲノム編集技術「Target-AID」を用いた品種改良を行うことを計画しています。また、トマトでは多遺伝子同時に、イネではより育種に関わる遺伝子を標的とした実証を進める予定です。
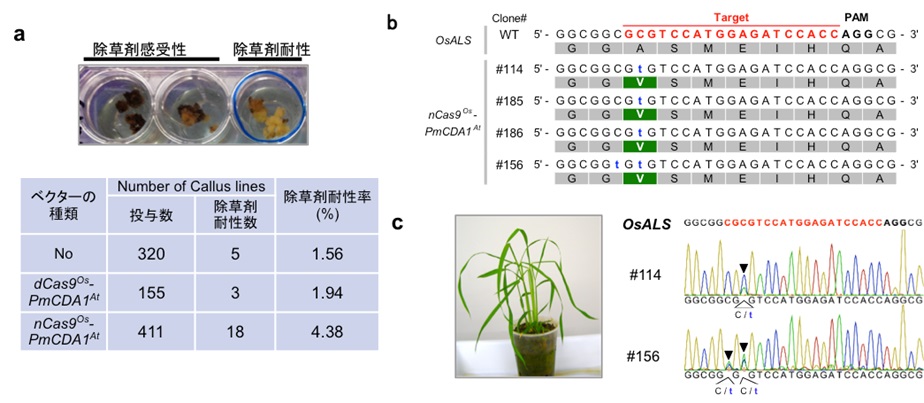
(a) イマザモックス耐性による選抜。最適化したTarget-AID (dCas9Os-PmCDA1AtまたはnCas9Os-PmCDA1At) によりゲノム編集をしたカルスは、除草剤耐性カルスの発現率が上がった。
(b) イマザモックス耐性をもったカルスのほとんどで、287番目のシトシン塩基がチミン塩基に置換することにより、96番目のアラニンがバリンに置換していた。(c) カルスは正常に再分化し、標的部位の配列は変異を保持していた。
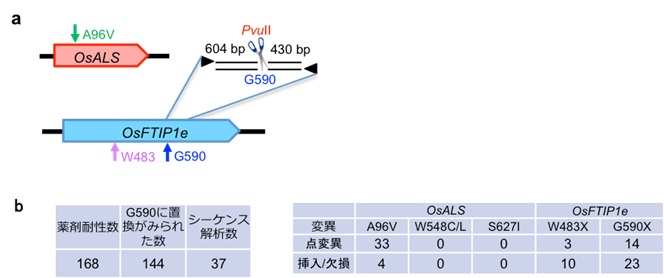
(a) 標的部位の模式図。OsALSの96番目のアラニンがバリンに置換、OsFTIPeの483番目のトリプトファン、590番目のグリシンのアミノ酸置換が引き起こるように設計した。
(b) イネALS遺伝子とOsFTIPe遺伝子の変異数の解析。3箇所同時に塩基の置換や挿入、欠損といった変異をもつ個体が確認された。
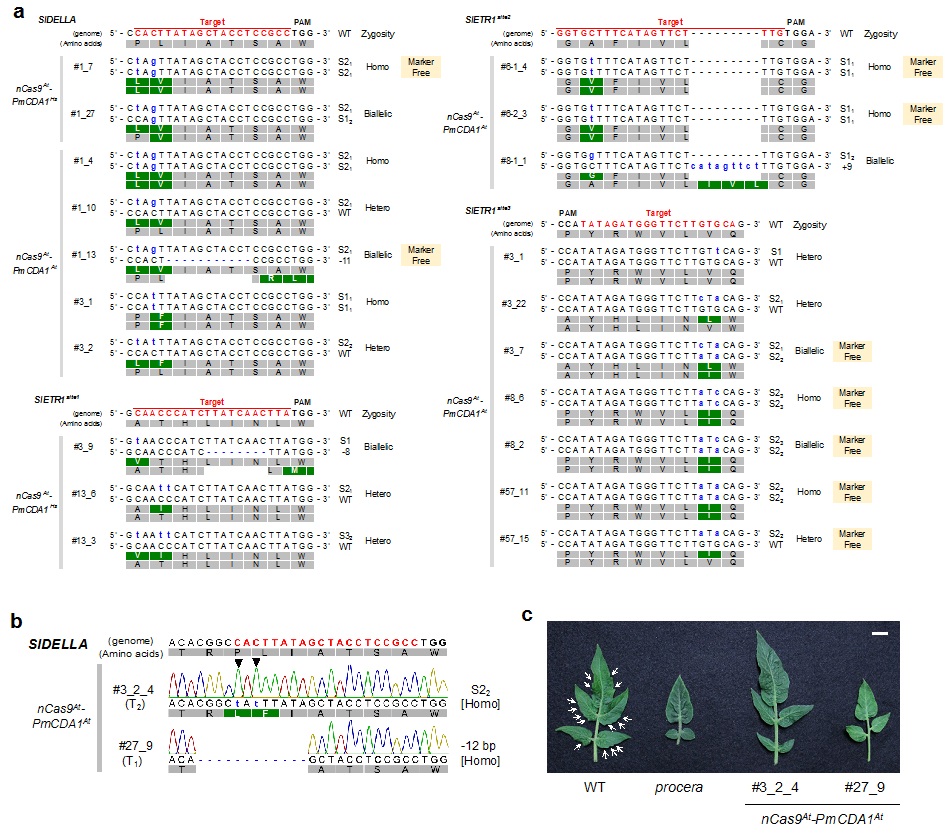
(a) トマトSlDELLAとSlETR1を標的としたT1世代の植物体の配列の解析。変異が見られるにも関わらず、ベクター配列が抜けている個体 (Marker Free) が獲得された。
(b) 2bpの塩基置換や12bpの欠損が見られた#3、#27の次世代の植物体では、ゲノム編集を行った代と同様の変異が見られ、変異が遺伝することを示した。
(c) さらに、これらはproceraという単為結果性を示す品種と同様の表現型を示した。
スケールバーは1cm。
用語解説
※1 SlETR1
olanum lycopersicum ETHYLENE RESPONSE1 (SlETR1) と呼ばれる、エチレンを感受する受容体の遺伝子。エチレン低感受性変異体Sletr1ではエチレンを感受する能力が大きく低下しており、日持ち性向上または完熟まで樹上で育成することが期待される。
※2 SlDELLA
ジベレリンは細胞伸長や種子発芽を促進に関わる植物ホルモンであるが、DELLAタンパク質はこのジベレリンの抑制に関わる転写因子である。また、SlDELLA変異体は受粉をしなくとも果実を形成する性質・単為結果性をもつことが知られている。単為結果性をもつ作物の作出は、受粉作業の労働時間や着果促進剤のコスト削減につながる。
研究助成
本研究 (の一部) は、内閣府 戦略的イノベーション創造プログラム (SIP)「次世代農林水産業創造技術」(管理法人:生研支援センター) によって実施されました。
参考文献
Nishida, K., T. Arazoe, N. Yachie, S. Banno, M. Kakimoto, M. Tabata, M. Mochizuki, A. Miyabe, M. Araki, K. Y. Hara, Z. Shimatani and A. Kondo: Targeted nucleotide editing using hybrid prokaryotic and vertebrate adaptive immune systems. Science, 10.1126/science.aaf8729 (2016).
論文情報
タイトル
“Targeted base editing in rice and tomato using a CRISPR-Cas9 cytidine deaminase fusion”
著者
Zenpei Shimatani, Sachiko Kashojiya, Mariko Takayama, Rie Terada, Takayuki Arazoe, Hisaki Ishii, Hiroshi Teramura, Tsuyoshi Yamamoto, Hiroki Komatsu, Kenji Miura, Hiroshi Ezura, Keiji Nishida, Tohru Ariizumi & Akihiko Kondo
掲載誌
Nature Biotechnology