神戸大学大学院医学研究科の齊藤泰之講師らの研究グループは、ヒト免疫細胞をマウス体内に有する免疫系ヒト化マウスを用いることで、ヒトB細胞リンパ腫内に浸潤したヒトマクロファージを標的とした薬剤 (ヒトSIRPα抗体) による治療効果を前臨床レベルで評価できることを明らかしました。本研究は、ヒト免疫細胞、特にこれまで技術的に困難であったヒトマクロファージを標的とした薬剤の有効性や作用機序を明らかにしたことから、本モデルを利用することで新たながん免疫療法の開発に直接繋がることが期待されます。
この研究成果は、2023年12月14日午前6時 (英国夏時間) に、国際免疫学会連合 (IUIS) の学術誌「Frontiers in Immunology」にオンライン掲載されました。
ポイント
- 免疫不全マウスにヒト造血幹細胞を投与して作成した免疫系ヒト化マウスを用い、B細胞リンパ腫に対するがん免疫療法モデルを新たに開発した。
- ヒトのマクロファージに特異的に作用するヒトSIRPα抗体とリツキシマブの併用により、B細胞リンパ腫の増殖が顕著に抑えられることを本モデルを用いて明らかにした。
- このマウスモデルは、今後ヒト免疫細胞に作用する新しい抗がん剤など治療薬の開発において、画期的なツールとなることが期待される。
研究の背景
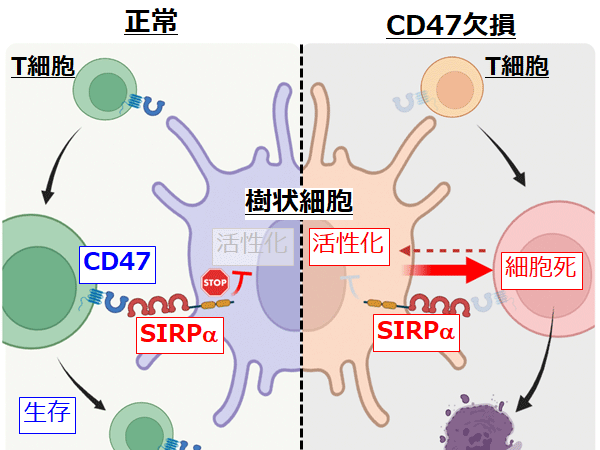
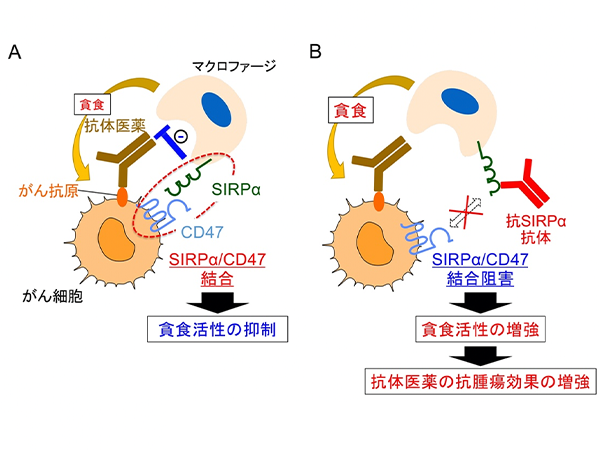
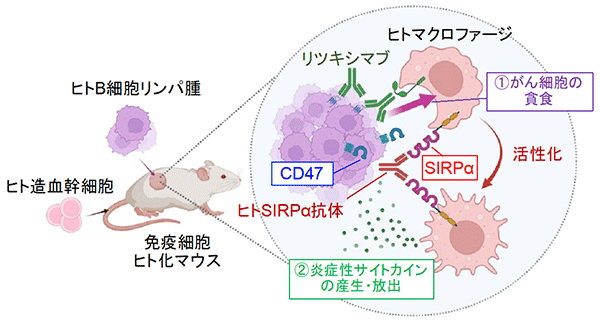
日本を含む先進国においてがんは死因の第一位を長らく占めており、がんに対する様々な治療法の開発が行われています。中でも、われわれの体に存在する免疫細胞を利用してがん細胞を排除するがん免疫療法が、近年がんに対する新たな治療戦略として注目されています。免疫細胞のうちマクロファージ※1は死細胞や病原体を取り込んで (貪食) 生体内から排除することから、この貪食機能を利用してがん細胞を排除する治療法が新たながん免疫療法として注目を集めています。本学医学研究科の的崎尚特命教授、齊藤泰之講師らの研究グループはマクロファージの細胞表面に特異的に発現する分子SIRPα (サープアルファ) ※2に結合し、リガンドであるCD47との結合を阻害するモノクローナル抗体※3を用いることで、マクロファージによるがん細胞の貪食が増強されることを動物モデルを用いてこれまで報告してきました。
SIRPαはヒトのマクロファージにも高発現することから、ヒトのSIRPαに作用する薬剤を用いることでマウスと同じようにヒトのがん、特に実際の患者由来のがんに対する新しい免疫療法となる可能性が想定されます。しかしながら、ヒトの免疫細胞に直接作用する薬剤の効果を検証する適切な実験モデルが存在しないため、これまではサルを用いた実験や臨床試験で被験者に投与する以外に検証する方法がありませんでした。
研究の内容
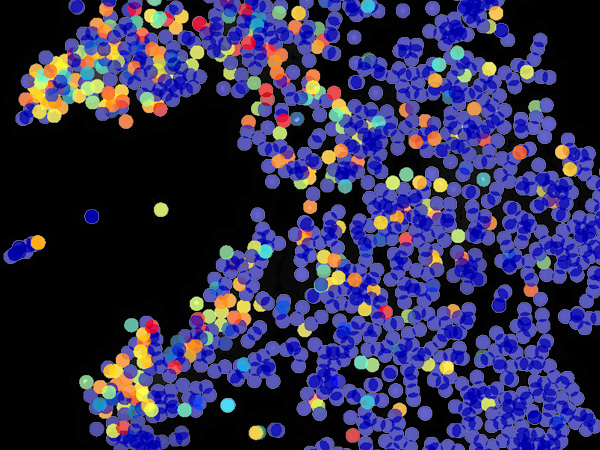
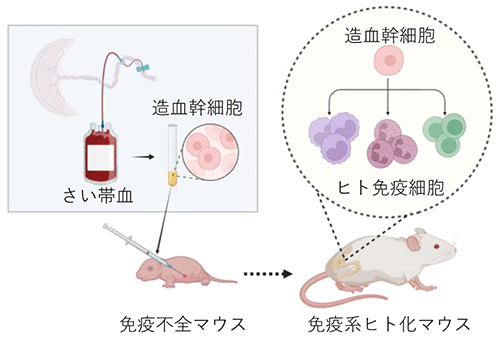
今回、齊藤講師らの研究グループは、免疫系ヒト化マウス※4を用いることで、ヒトB細胞リンパ腫※5に対する免疫療法モデルを新たに樹立しました。このマウスはマクロファージを含む免疫細胞の多くがヒト由来の免疫細胞に置き換わっており、このマウスにヒトのがん細胞を移植することで、がんに対するヒト免疫細胞による免疫応答ならびに免疫療法の評価が可能になります (図1)。
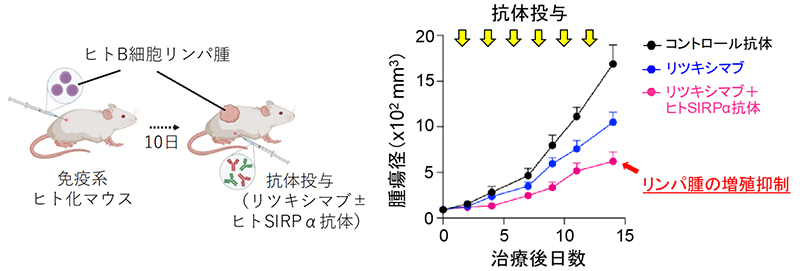
そこで、ヒト免疫細胞、中でもヒトマクロファージに特異的に結合するヒトSIRPα抗体の有効性を前臨床レベルで検証するため、株化したB細胞リンパ腫細胞を免疫系ヒト化マウスの皮下に接種しました。10日後、リンパ腫が生着した免疫系ヒト化マウスに対し、マクロファージに高発現するSIRPαに結合し、リガンドであるCD47との結合を阻害する抗ヒトSIRPαモノクローナル抗体 (ヒトSIRPα抗体) による治療効果の検討を行いました。コントロール抗体や抗CD20モノクローナル抗体 (リツキシマブ) ※6のみを投与した治療群に比べ、ヒトSIRPα抗体とリツキシマブを同時に投与した免疫系ヒト化マウスでは、皮下に接種したリンパ腫の増殖が有意に抑えられていました (図2)。このことから、ヒトSIRPα抗体はリツキサンの作用を増強することでリンパ腫に対してより強い治療効果をもたらすことが明らかとなりました。
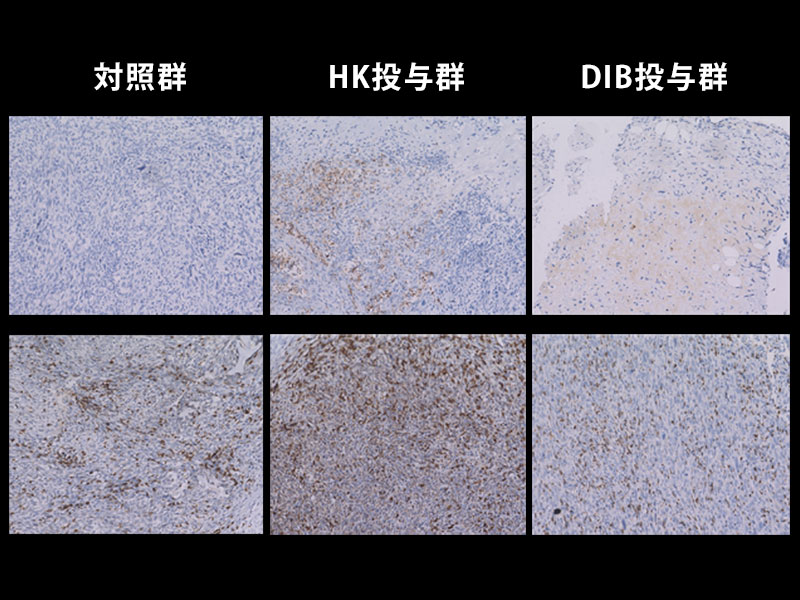
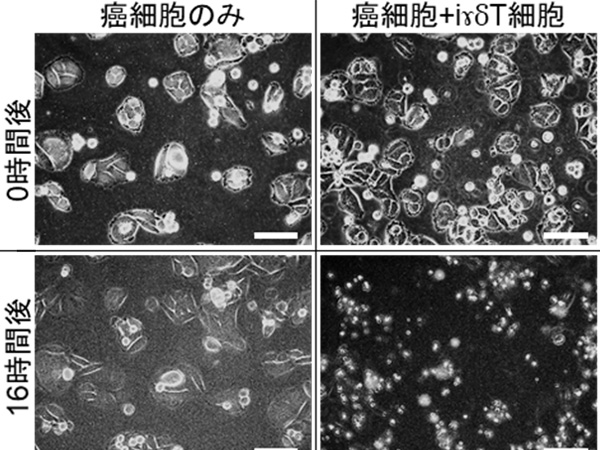
次にヒトSIRPα抗体によるリツキシマブの増強効果がマクロファージに依存しているか検証する目的で、マクロファージを薬剤により除去したところ、リツキシマブ+ヒトSIRPα抗体投与による治療効果を認めませんでした (図3A)。さらに、ヒトマクロファージによるリンパ腫の取り込みがリツキシマブ+ヒトSIRPα抗体投与により実際に増強されていたことから、ヒトSIRPα抗体はがん細胞の貪食を増強させる働きを有することが明らかとなりました。さらに、ヒトSIRPα抗体とリツキシマブの併用投与後のマクロファージを単離して遺伝子の発現を調べたところ、炎症性サイトカイン遺伝子の発現などが増加していました (図3B)。このことから、ヒトSIRPα抗体とリツキシマブの併用により腫瘍内のマクロファージが活性化する可能性が示唆されました。
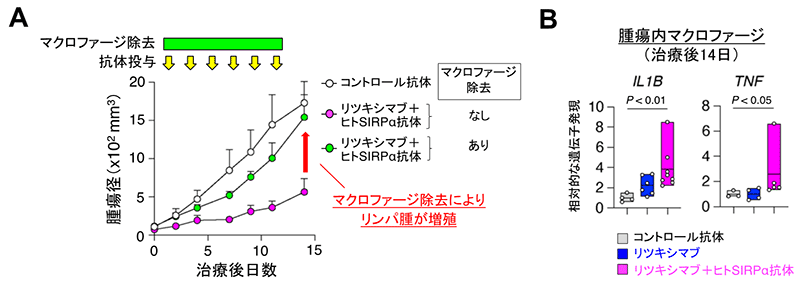
(B) 図2の治療モデルマウスの腫瘍よりヒトマクロファージを単離し遺伝子発現の解析を行なったところ、コントロール抗体群に比べ、ヒトSIRPα抗体とリツキシマブを投与した免疫系ヒト化マウス由来のマクロファージは炎症性サイトカインであるIL-1βならびにTNFの発現が有意に増加していた。
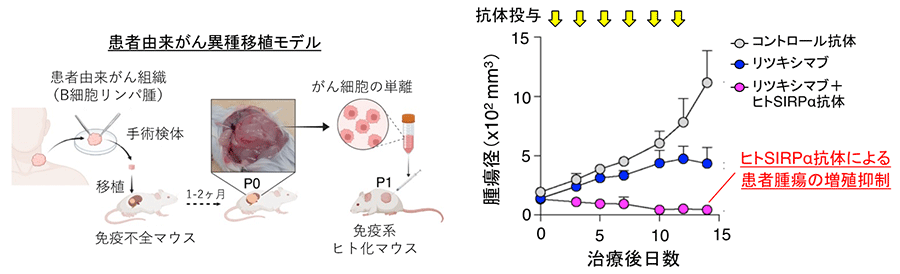
最後に、ヒトSIRPα抗体が実際の患者由来のがんに対して実際に効果を有するかを検討するため、びまん性大細胞型B細胞リンパ腫の患者より摘出した腫瘍を免疫系ヒト化マウスに移植する実験系 (PDXモデル) ※7を用いました (図4)。ヒトSIRPα抗体とリツキシマブの併用により、生着した患者由来の腫瘍の増殖が著しく抑えられ、さらに一部のマウス個体では腫瘍が消失しました。
本研究結果により、免疫系ヒト化マウスを用いることで腫瘍内のマクロファージを標的とした治療効果が検証できることが示されました。リンパ腫に対してヒトSIRPα抗体はマクロファージによるリツキシマブ依存性の貪食作用を増強するだけでなく、マクロファージを活性化させることで腫瘍を排除させる作用を増強させることが示されました (図5)。免疫系ヒト化マウスはこれまで主に感染症の研究分野で用いられてきましたが、がん免疫療法の研究においても有用であり、本研究により世界で初めてヒトマクロファージを標的とした治療の効果を免疫系ヒト化マウスを用いて検証することに成功しました。
今後の展開
現在、研究グループはSIRPαを標的としたがん治療薬の開発に取り組んでいます。SIRPα抗体はマクロファージががん細胞を攻撃する際の分子ブレーキ (免疫チェックポイント) として働くことから、現在がんに対する新しい免疫療法として国内外の製薬会社による開発競争が行われています。本研究で開発した免疫系ヒト化マウスによるがん免疫療法モデルを用いることで、臨床試験を行う前の薬剤の最適化や副作用の検討、さらには患者個々の腫瘍に最適な治療法の検討など、実際のがん治療に直接関与する研究に結び付けられることが可能となります。一方で、これらの実現には幾つかの課題点が今回の研究により明らかになったことから、現在研究グループは免疫系ヒト化マウスを用いた前臨床モデルの更なる改良を進めています。
用語解説
※1 マクロファージ
生体内に侵入した病原体などを貪食し排除する (自然免疫と呼ばれる) のに特化した免疫細胞。また、老化した細胞やがん細胞などを貪食し、生体内からの不要な細胞の排除に関わる。
※2 SIRPα (サープアルファ)
細胞の内外を分ける細胞膜上に存在する膜タンパク質の一つで、マクロファージに豊富に存在している。SIRPαはマクロファージの貪食標的となる細胞上の別の膜タンパク質CD47と結合することで、その貪食の活性調節を担っている。SIRPαは、Signal regulatory protein αの略。
※3 モノクローナル抗体
抗体はリンパ球であるB細胞により産生され、抗原と呼ばれる特定の分子 (タンパク質など) と特異的に結合する性質を持つ。特定の抗原にだけ結合する抗体を、人工的にクローン (クローナル) 増殖させたものがモノクローナル抗体であり、がんに対する分子標的薬などに利用されている。
※4 免疫系ヒト化マウス
さい帯血などから抗体を用いて単離したヒト由来の造血幹細胞をマウスに投与した場合、マウスの免疫細胞は投与されたヒト細胞を異物と認識して排除 (拒絶) するが、T細胞やB細胞を欠損させた免疫機能を持たない免疫不全マウスにヒト造血幹細胞を投与した場合、造血幹細胞から分化したヒトの免疫細胞がマウス内で産生されるようになる (免疫系ヒト化マウス)。免疫不全マウスの種類により産生されるヒト免疫細胞の種類や性質が異なるため、現在様々な種類の免疫系ヒト化マウスが研究で用いられている。
※5 B細胞リンパ腫
悪性リンパ腫の一種で、リンパ球のうちB細胞 (Bリンパ球) ががん化したリンパ腫。わが国のリンパ腫の8割以上を占め、びまん性大細胞型B細胞リンパ腫や濾胞性リンパ腫など様々な種類のリンパ腫に細分化される。
※6 抗CD20モノクローナル抗体 (リツキシマブ)
B細胞ならびにB細胞リンパ腫の細胞膜に存在するCD20抗原 (タンパク質) と特異的に結合する抗体 (抗CD20抗体) であり、B細胞リンパ腫や白血病に対する分子標的薬 (抗体医薬) として用いられている。
※7 患者由来がん異種移植モデル (PDXモデル)
手術などで患者より取り出したがん検体を免疫不全マウスに移植して構築したがんモデル動物。旧来の培養細胞や遺伝子操作したマウスモデルよりも、がんの増殖や転移をより忠実に再現すると考えられており、がんの新規治療を効率的に開発し臨床導入するための前臨床試験モデルや患者個々で異なるがんの性質を再現した個別化治療のモデル動物として期待されている。
謝辞
本研究は、ひょうご臍帯血バンクより提供された研究用臍帯血を用いて実施されました。また、日本医療研究開発機構 (AMED) 次世代がん医療加速化研究事業 (P-PROMOTE) ならびに次世代がん医療創生研究事業 (P-CREATE)、JST共創の場形成支援プログラム (COI-NEXT)、科学研究費補助金事業基盤研究 (A)、同事業挑戦的研究 (萌芽)、同事業若手研究、ならびに武田医学振興財団、日本血液学会研究助成金、ブリストルマイヤーズスクイブ株式会社研究助成金の支援を受けて実施されました。
論文情報
タイトル
“Preclinical evaluation of the efficacy of an antibody to human SIRPα for cancer immunotherapy in humanized mouse models”
(ヒト化マウスモデルを用いた抗ヒトSIRPα抗体によるがん免疫療法の前臨床治療効果の検討)DOI
10.3389/fimmu.2023.1294814
著者
齊藤泰之1) *、飯田理恵1)、Afroj Tania1)2)、Refaat Alla1)、羽間大祐1)、小森里美1)2)、 大幡真也3)、高井智子1)2)、Oduori Okechi S1)2)、小谷武徳1)、船越洋平3)、狛 雄一朗4)、村田陽二1)、薬師神公和3)、松岡 広5)、南 博信3)、横崎 宏4)、Manz Markus G6)7)、 的崎 尚1)2)
*責任著者
1) 神戸大学大学院医学研究科 生化学・分子生物学講座 生化学・シグナル統合学分野 (シグナル統合学)
2) 神戸大学大学院医学研究科 生化学・分子生物学講座 生体シグナル制御学部門
3) 神戸大学医学部附属病院 腫瘍・血液内科
4) 神戸大学大学院医学研究科 病理学講座 病理学分野
5) 神戸大学医学部附属病院 バイオリソースセンター
6) チューリッヒ大学病院 腫瘍血液内科
7) チューリッヒ大学 がん総合センター掲載誌
Frontiers in Immunology